平安证券研报显示,相对于小分子化药,多肽药物具有更高的生物活性和更强的特异性;相对于蛋白质药物,多肽药物具有免疫原性低、纯度高、生产成本较低等优势。总体来说,多肽药物具有高活性、低剂量、低毒性的特点。
根据2021年Nature Reviews Drug Discovery报道,全球上市的多肽药物已有80多种,在已获批多肽药物中,抗肿瘤、内分泌和代谢适应症是目前多肽药物的主要应用场景,在急慢病领域具备竞争优势。例如风靡全球的“减肥神药”司美格鲁肽即为多肽药物,其口服片剂在减肥领域的应用是未来主要看点。但是开发口服多肽类药物一直面临着多重挑战,口服多肽类药物的研发有多难?
1921年8月,两名加拿大医生在狗的胰腺中成功提取出了胰岛素,并用于人类糖尿病的治疗,开启了多肽类药物的先河。自此,应用于血栓、贫血、发育迟缓和骨质疏松等多种疾病治疗的低分子肝素,舒洛地特,红细胞生成素(EPO),特立帕肽等多肽类药物不断被研发出来,这类药物都具有信号调节能力,可以修复病理性的蛋白代谢功能紊乱。
多肽类药物发挥其巨大的治疗潜能的同时,都因一个痛点被医生和患者长期诟病:因为口服生物利用度差,多肽类药物基本都是注射给药。长期连续的注射给药,对患者的依从性造成巨大挑战。很多患者由于疼痛、对注射的厌恶和局部刺激等问题不得不放弃或中断注射治疗,并希望有给药途径替代注射给药。虽然在近半个世纪里,科研人员已经研发出口服多肽类药物,可让人无奈的是进展乏善可陈。最近互联网上热度非常高的降糖多肽类药物司美格鲁肽口服剂型在全球主要国家的陆续上市,再次将口服多肽类药物的话题带回了大众的视野。
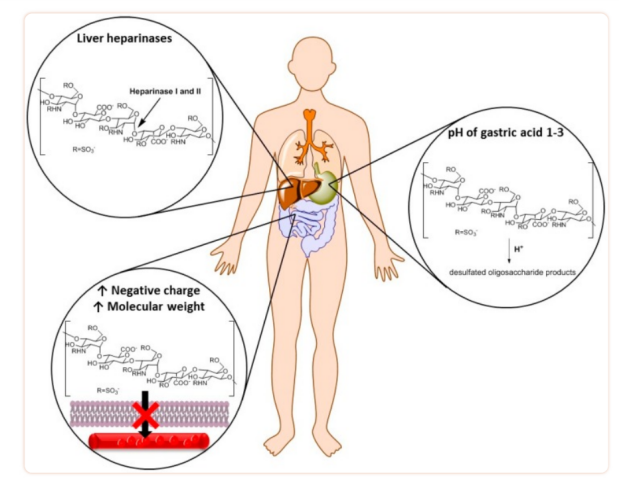
开发口服多肽类药物一直面临着多重挑战,包括多肽链稳定性欠佳、易被肠黏膜表面的黏液层“捕获”和清除,渗透性差和难以吸收。现在“战场”上的局面是,由于三大“刺客”(消化酶、胃内酸性环境和肝脏首过效应)的存在,疗效大打折扣,排第一位的刺客就是胃肠道内的消化酶。
在人类生存法则里,压倒一切的是新陈代谢。消化和吸收是我们经口摄入任何物质后必经的一道工序。在这道复杂的工序里,我们吃进去的物质要被降解成基本的分子,例如淀粉降成单糖,脂肪降成脂肪酸,蛋白质降成氨基酸。执行这些降解操作的主要战斗单元,就是我们熟知的消化酶类,它们既是食物的挚友,也是多肽类药物的死敌。
我们先从多肽的结构说起,来详细了解下消化酶是如何消化胃肠道内多肽的。众所周知,氨基酸是蛋白质和多肽的基本组成单位。氨基酸由肽键连接在一起,形成一条多肽链,这就是蛋白质和多肽的一级结构。多肽链在空间上有规律的折叠和盘绕形成了二级结构。多肽链进一步盘绕、卷曲和折叠形成了结构。这种分子结构及空间构型是实现多肽功能和活性的必要条件,缺少一个氨基酸或空间结构被破坏都会让多肽失去活性。
蛋白质及多肽进入胃肠道后,胃肠道的消化液会将其消化分解成各种氨基酸,这个过程是由胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、氨肽酶和二肽酶等多种消化酶参与实现的。这些消化酶作用在多肽链的特定位点上,例如:胰蛋白酶主要作用位点是肽链中赖氨酸或精氨酸后面的肽键;胃蛋白酶主要作用位点是肽链中苯丙氨酸、色氨酸、酪氨酸等疏水氨基酸后面的肽键。因此,特定肽键位点在胰岛素、生长激素、类肝素等多肽类药物中的分布丰度造成了药物对各种蛋白酶不同的敏感度。分子量越大的多肽链在胃液中越容易被分解,因为这些多肽链的消化酶切割位点明显多于分子量较小的多肽链,更容易被消化酶切割,大分子的多肽药物一般情况下到达小肠时已经“香消玉殒”。
与精准切割多肽链内的肽键相比,更为宏观的消化方式是蛋白质的空间解构。胃肠道内的消化酶个个都像魔术大师,都能把“水火交攻”的把戏玩得炉火纯青,把蛋白质的特定空间结构消弭殆尽。在消化过程中,不管是作为食物的蛋白质还是作为药物的多肽链,都经历了“煮、蒸、炒”三次拆解和断裂,变成单个的氨基酸零件,进入了下一次的生物轮回,原本的药物活性也不复存在。
抗凝专业临床药师,中国民族医药学会信息与大数据分会理事,武汉药学会青年药师专业委员会,中国药师杂志编委,主持国家自然科学青年基金1项,主持湖北省卫健委课题1项,获得湖北省科技进步三等奖2项、二等奖2项,获得中国药学会施维雅青年医院药学奖,以第一作者发表论文二十余篇。